- THERMODYNAMIQUE - Thermodynamique technique
- THERMODYNAMIQUE - Thermodynamique techniqueLa thermodynamique technique applique les premier et second principes aux machines thermiques. La liquéfaction des gaz, l’industrie frigorifique, le fonctionnement des pompes à chaleur, la climatisation, les moteurs à combustion, etc., sont autant de domaines concernés par ces lois, et les diagrammes et cycles qu’on peut en déduire.1. Application du premier principe aux machines thermiques. Travail utile et détente de Joule-ThomsonAu point de vue de la thermodynamique, une machine thermique est un système ouvert, car elle comporte généralement une section d’entrée A et une section de sortie B pour le fluide en évolution. Le travail correspondant p V = p BVB 漣 p AVA, fourni par la machine, s’ajoute algébriquement au travail utile Wu pour lequel elle a été conçue. Il en résulte que, dans un système unifié d’unités, le principe de conservation de l’énergie s’écrit pour un fonctionnement stationnaire (ou bien pour un fonctionnement périodique si les grandeurs représentent des valeurs moyennes prises sur un nombre entier de périodes):
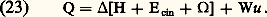 Ici, Q désigne la chaleur fournie par le milieu extérieur et 行 est l’accroissement d’énergie potentielle entre A et B. Cette dernière est généralement négligeable dans le cas des gaz et des vapeurs. D’autre part, selon que Wu est positif ou négatif, la machine thermique est dite motrice ou opératrice . Pour une tuyère de détente, la vitesse rapidement croissante du fluide permet de considérer l’évolution comme pratiquement adiabatique (d Q = 0). On a de plus Wu = 0 si la tuyère est fixe, et la relation (23) se simplifie sous la forme:
Ici, Q désigne la chaleur fournie par le milieu extérieur et 行 est l’accroissement d’énergie potentielle entre A et B. Cette dernière est généralement négligeable dans le cas des gaz et des vapeurs. D’autre part, selon que Wu est positif ou négatif, la machine thermique est dite motrice ou opératrice . Pour une tuyère de détente, la vitesse rapidement croissante du fluide permet de considérer l’évolution comme pratiquement adiabatique (d Q = 0). On a de plus Wu = 0 si la tuyère est fixe, et la relation (23) se simplifie sous la forme: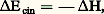 d’après laquelle les accroissements d’énergie cinétique proviennent des chutes d’enthalpie du fluide. Plus particulièrement, la notion d’enthalpie d’arrêt , résultant d’un jet arrêté par un obstacle immobile (ou, vice versa, pour la pénétration dans l’atmosphère terrestre), dérive de la même loi, sous la forme:
d’après laquelle les accroissements d’énergie cinétique proviennent des chutes d’enthalpie du fluide. Plus particulièrement, la notion d’enthalpie d’arrêt , résultant d’un jet arrêté par un obstacle immobile (ou, vice versa, pour la pénétration dans l’atmosphère terrestre), dérive de la même loi, sous la forme: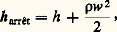 福 étant la densité de l’air et w sa vitesse. Un autre exemple est celui du robinet détendeur d’un fluide en mouvement lent tant à l’amont qu’à l’aval de l’étranglement. On a, cette fois, Q = Wu = 行 = Ecin = 0, d’où, d’après (23), H = 0. Il s’ensuit que l’état initial et l’état final sont situés sur une isenthalpique : d H = 0 ou H = C te . Les propriétés de l’isenthalpique sont connues par l’étude de l’effet Joule-Thomson (effet J.-T.) où le détendeur est remplacé par un bourrage amortissant la vitesse à tout instant. On obtient l’égalité:
福 étant la densité de l’air et w sa vitesse. Un autre exemple est celui du robinet détendeur d’un fluide en mouvement lent tant à l’amont qu’à l’aval de l’étranglement. On a, cette fois, Q = Wu = 行 = Ecin = 0, d’où, d’après (23), H = 0. Il s’ensuit que l’état initial et l’état final sont situés sur une isenthalpique : d H = 0 ou H = C te . Les propriétés de l’isenthalpique sont connues par l’étude de l’effet Joule-Thomson (effet J.-T.) où le détendeur est remplacé par un bourrage amortissant la vitesse à tout instant. On obtient l’égalité: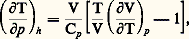 d’où il résulte que la détente est accompagnée d’un refroidissement (effet J.-T. 礪 0), ou d’un échauffement (effet J.-T. 麗 0), selon que le coefficient de dilatation du fluide:
d’où il résulte que la détente est accompagnée d’un refroidissement (effet J.-T. 礪 0), ou d’un échauffement (effet J.-T. 麗 0), selon que le coefficient de dilatation du fluide: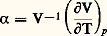 est plus grand ou plus petit que celui du gaz parfait 見gp = -1. Le cas limite d’égalité correspond à l’inversion de l’effet J.-T. Dans les conditions de l’atmosphère ambiante, l’oxygène et l’azote de l’air subissent un refroidissement par détente, et cet effet a été exploité par Carl von Linde (1842-1934) pour réaliser, en 1895, la liquéfaction de l’air [cf. CRYOLOGIE - Cryophysique]. En revanche, placés dans les mêmes conditions, l’hydrogène et l’hélium subissent un échauffement par ce type de détente appelée souvent détente sans travail extérieur . Le procédé de liquéfaction par détente avec production de travail extérieur a été utilisé avec succès quelques années plus tard par Georges Claude (1870-1960). Depuis lors, tous les gaz, réputés jadis permanents, ont été liquéfiés. Le dernier d’entre eux, l’hélium, a été liquéfié, en 1908, à Leyde, par H. Kamerlingh Onnes (1853-1926), qui devait aussi découvrir, en 1911, la supraconductivité des métaux (cf. CRYOLOGIE, SUPRACONDUCTIVITÉ). La séparation industrielle des gaz par voie de distillation consécutive à leur liquéfaction a été réalisée vers la même époque.2. Application du second principe aux machines thermiques. Optimisation et énergie utilisableSous le rapport du second principe, il faut souligner l’influence sur le progrès des machines [cf. MOTEURS THERMIQUES] de la formule de Carnot donnant le rendement optimal des cycles moteurs sous la forme 兀 = (T2 漣 1)2. Dans le cas de la machine à vapeur, la température 1 est celle du milieu ambiant. La seule possibilité est alors d’avoir recours à une source chaude dont la température 2 soit aussi élevée que possible, d’où le développement de la technique des chaudières à haute pression, d’après la loi de Clapeyron (cf. THERMODYNAMIQUE – Lois fondamentales, chap. 3).Pour les cycles inverses, le rendement optimal est encore fourni par la formule de Carnot. On l’écrit:
est plus grand ou plus petit que celui du gaz parfait 見gp = -1. Le cas limite d’égalité correspond à l’inversion de l’effet J.-T. Dans les conditions de l’atmosphère ambiante, l’oxygène et l’azote de l’air subissent un refroidissement par détente, et cet effet a été exploité par Carl von Linde (1842-1934) pour réaliser, en 1895, la liquéfaction de l’air [cf. CRYOLOGIE - Cryophysique]. En revanche, placés dans les mêmes conditions, l’hydrogène et l’hélium subissent un échauffement par ce type de détente appelée souvent détente sans travail extérieur . Le procédé de liquéfaction par détente avec production de travail extérieur a été utilisé avec succès quelques années plus tard par Georges Claude (1870-1960). Depuis lors, tous les gaz, réputés jadis permanents, ont été liquéfiés. Le dernier d’entre eux, l’hélium, a été liquéfié, en 1908, à Leyde, par H. Kamerlingh Onnes (1853-1926), qui devait aussi découvrir, en 1911, la supraconductivité des métaux (cf. CRYOLOGIE, SUPRACONDUCTIVITÉ). La séparation industrielle des gaz par voie de distillation consécutive à leur liquéfaction a été réalisée vers la même époque.2. Application du second principe aux machines thermiques. Optimisation et énergie utilisableSous le rapport du second principe, il faut souligner l’influence sur le progrès des machines [cf. MOTEURS THERMIQUES] de la formule de Carnot donnant le rendement optimal des cycles moteurs sous la forme 兀 = (T2 漣 1)2. Dans le cas de la machine à vapeur, la température 1 est celle du milieu ambiant. La seule possibilité est alors d’avoir recours à une source chaude dont la température 2 soit aussi élevée que possible, d’où le développement de la technique des chaudières à haute pression, d’après la loi de Clapeyron (cf. THERMODYNAMIQUE – Lois fondamentales, chap. 3).Pour les cycles inverses, le rendement optimal est encore fourni par la formule de Carnot. On l’écrit: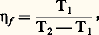 pour une machine frigorifique, c’est-à-dire lorsque la source chaude correspond au milieu ambiant, et:
pour une machine frigorifique, c’est-à-dire lorsque la source chaude correspond au milieu ambiant, et: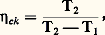 pour une pompe de chaleur (pompe Kelvin), lorsque c’est la source froide 1 qui correspond au milieu ambiant. Dans les deux cas, on appelle plus volontiers puissance frigorifique spécifique et puissance calorifique spécifique ces rapports dont la valeur est généralement plus grande que l’unité.En ce qui concerne les machines fonctionnant au moyen d’une seule source, appelées systèmes monothermiques , les moteurs à combustion interne par exemple, la formule des cycles ne convient pas comme base de comparaison. L’expression appropriée du travail utile optimal se déduit aussi du second principe, mais, cette fois, sous la forme du théorème de Maxwell-Gouy :
pour une pompe de chaleur (pompe Kelvin), lorsque c’est la source froide 1 qui correspond au milieu ambiant. Dans les deux cas, on appelle plus volontiers puissance frigorifique spécifique et puissance calorifique spécifique ces rapports dont la valeur est généralement plus grande que l’unité.En ce qui concerne les machines fonctionnant au moyen d’une seule source, appelées systèmes monothermiques , les moteurs à combustion interne par exemple, la formule des cycles ne convient pas comme base de comparaison. L’expression appropriée du travail utile optimal se déduit aussi du second principe, mais, cette fois, sous la forme du théorème de Maxwell-Gouy :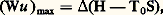 où 0 est la température absolue de l’unique thermostat extérieur, le milieu ambiant. On a donné le nom d’énergie utilisable et aussi celui de pouvoir énergétique à la quantité H 漣 0S qu’il convient de distinguer de l’énergie libre de Gibbs car elle n’est pas une fonction d’état puisqu’elle contient la température extérieure 0. Sous ce rapport, la dénomination plus récente d’exergie rencontrée parfois, prête à l’équivoque. Le rapport (Wu /Wu max) représente l’expression générale du rendement thermodynamique d’un système monothermique moteur. En première approximation, ce rapport correspond à la formule employée en pratique Wu /Pp , où Pp = H désigne le pouvoir calorifique à pression constante du combustible utilisé. Il faut noter enfin que la recherche du rendement maximum d’un moteur thermique correspond aussi à celle du travail maximum accompli par le fluide évoluant, soit entre deux états distincts, soit le long d’un cycle, au moyen d’une quantité de chaleur Q2 déterminée et empruntée à la source chaude. Cette constatation résulte directement de la définition du rendement :
où 0 est la température absolue de l’unique thermostat extérieur, le milieu ambiant. On a donné le nom d’énergie utilisable et aussi celui de pouvoir énergétique à la quantité H 漣 0S qu’il convient de distinguer de l’énergie libre de Gibbs car elle n’est pas une fonction d’état puisqu’elle contient la température extérieure 0. Sous ce rapport, la dénomination plus récente d’exergie rencontrée parfois, prête à l’équivoque. Le rapport (Wu /Wu max) représente l’expression générale du rendement thermodynamique d’un système monothermique moteur. En première approximation, ce rapport correspond à la formule employée en pratique Wu /Pp , où Pp = H désigne le pouvoir calorifique à pression constante du combustible utilisé. Il faut noter enfin que la recherche du rendement maximum d’un moteur thermique correspond aussi à celle du travail maximum accompli par le fluide évoluant, soit entre deux états distincts, soit le long d’un cycle, au moyen d’une quantité de chaleur Q2 déterminée et empruntée à la source chaude. Cette constatation résulte directement de la définition du rendement :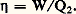 Un tout autre problème d’optimisation revient à imposer, non pas Q2 mais la durée t du processus envisagé. On se trouve dès lors, toujours par définition, en présence d’un problème d’optimisation de la puissance moyenne :
Un tout autre problème d’optimisation revient à imposer, non pas Q2 mais la durée t du processus envisagé. On se trouve dès lors, toujours par définition, en présence d’un problème d’optimisation de la puissance moyenne :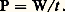 Dans ce dernier cas, et contrairement au précédent, la solution est liée à la durée du processus ce qui implique fatalement l’intervention des lois cinétiques de transport (conduction, convection, rayonnement) étrangères à la thermodynamique et souvent même partiellement empiriques. On ne peut traiter que des cas particuliers et sous ce rapport, la dénomination de Thermodynamique à temps fini parfois utilisée pour ce genre de problème est pour le moins inappropriée, sinon redondante.3. Diagrammes d’état. Cycles et pseudocycles usuelsLe diagramme thermodynamique pression-volume, dénommé diagramme de Clapeyron, ou en bref diagramme (p , V), est manifestement le plus simple à interpréter à partir de connaissances élémentaires. De plus, son analogie avec les relevés de l’indicateur de Watt ont répandu son emploi depuis le début de l’ère des machines à pistons. Néanmoins il est loin d’être le plus commode et le plus instructif pour qui est quelque peu familiarisé avec la seconde loi de la thermodynamique. Cette réflexion, déjà inspirée à J. W. Gibbs semble bien avoir été le stimulant initial en faveur de l’élaboration de son important mémoire consacré aux diagrammes et aux surfaces thermodynamiques. Les constructions géométriques qu’il a fait connaître ont largement contribué à répandre l’usage des méthodes graphiques dans cette discipline.Sous ce rapport, le diagramme température-entropie, appelé aussi diagramme entropique ou diagramme (T, S), mérite quelques commentaires. Ainsi que le montre la figure 1, le cycle réversible de Carnot qui assure le rendement optimum d’une machine fonctionnant entre deux températures données 1 et 2, y est représenté par un simple rectangle. En outre, l’aire de ce rectangle mesure le travail accompli au cours du cycle, alors que l’aire 1-2-5-6, étendue jusqu’au zéro absolu, mesure la chaleur fournie par la source chaude 2. Il en résulte enfin que le rendement moteur s’interprète graphiquement par le rapport du segment 1-4 au segment 1-6. Cette propriété est générale car indépendante de la nature du milieu en évolution. Elle s’applique en outre à tous les cycles réversibles, comme on peut l’observer sur la figure 2. Le travail y est encore mesuré par l’aire de la boucle et la chaleur fournie par l’aire 6-1-2-3-5, tandis que la représentation du rendement correspond ici au rapport de ces deux aires.D’autre part, l’application du diagramme entropique au domaine des gaz parfaits, où il porte le nom de diagramme de Stodola conduit directement à la construction graphique exposée à l’article ENTROPIE. La famille des isobares (pression constante) ainsi que celle des isomètres (ou isochores, volume constant), obtenues à partir de l’une d’entre elles par simple déplacement parallèle à l’axe des abscisses, forment un réseau d’exponentielles ayant respectivement pour sous-tangente les capacités calorifiques Cp et Cv supposées constantes dans la région envisagée. C’est ainsi notamment que le cycle de Joule défini au moyen de deux isobares et de deux adiabatiques réversibles (S = C te ) s’y représente sans difficulté. Il a connu un regain d’intérêt par suite de l’important développement de l’industrie des turbines à gaz.Dans le domaine des vapeurs condensables, ce même type de cycle porte le nom de Rankine ou de Rankine-Hirn, selon que la vaporisation est arrêtée à la sortie de la chaudière (cf. fig. 3, point 4 de saturation sèche; cas de la machine à pistons), ou qu’elle est prolongée par une surchauffe supplémentaire (point 5, cas de la turbine). La position de ce dernier point doit permettre d’accomplir la détente adiabatique ultérieure 5-6, à l’abri de toute manifestation de condensation. En effet, la vitesse généralement considérable atteinte par la vapeur au cours de sa détente provoquerait fatalement une dangereuse abrasion du métal des parois par suite de la projection violente des gouttelettes engendrées.Dans le cas fréquent où le volume spécifique du liquide est négligeable devant celui de la vapeur en équilibre, le travail utile de compression (Vliq p ) par unité de masse, consommé par la pompe d’alimentation de la chaudière, l’est également. Dès lors, les points 1 et 2 de la figure 3 sont régulièrement confondus dans les diagrammes usuels (superposition du réseau des isobares de l’état liquide à la courbe limite de la zone d’équilibre x = 0).Les conséquences du premier principe présentées soit sous la forme (23), ci-dessus, soit sous la forme (3) de l’article B (Lois fondamentales), confèrent aux accroissements d’enthalpie, des propriétés énergétiques essentielles, telles que la mesure de la chaleur échangée avec le milieu extérieur le long d’un arc d’isobare, la mesure du travail utile ou celle d’un accroissement d’énergie cinétique, le long d’un tronçon d’adiabatique. Ces diverses propriétés ont largement contribué à mettre en valeur l’intérêt du diagramme enthalpie – entropie H, S, de Mollier, où ces accroissements sont directement mesurés par de simples différences d’ordonnées. Il possède de surcroît l’avantage de permettre la représentation graphique des propriétés des mélanges. En effet, tout diagramme reposant sur le choix de coordonnées homogènes et linéaires par rapport aux masses autorise l’application graphique de la règle des mélanges, soit, en d’autres termes, la détermination classique d’un centre de masse. C’est ainsi que le diagramme (V, S) de Gibbs permet de remplacer par un triangle l’état triple réduit à un point dans le diagramme température-pression (T, p ).La possibilité d’une représentation simultanée de la règle des mélanges et des lois d’équilibre devait permettre ultérieurement à l’école hollandaise de Van der Waals, Kamerlingh-Onnes, Keesom, de Haas et quelques autres d’utiliser le diagramme (H, S, titre), pour leurs études graphiques de séparation, rectification, et distillation des mélanges binaires, consécutifs à la liquéfaction des gaz aux basses températures. Il faut citer aussi parallèlement les importantes contributions théoriques de Duhem en France sur les propriétés des nappes d’ébullition et de condensation, à partir des mêmes méthodes.À présent, l’usage des diagrammes et surfaces thermodynamiques s’est répandu dans les domaines les plus variés de la discipline. Les uns concernent la climatisation et le conditionnement de l’air (diagrammes psychrométriques), les autres, l’industrie frigorifique, où la multiplication du nombre des agents appropriés aux différentes régions de températures, tantôt basses, tantôt relativement élevées pour les pompes à chaleur, a entraîné la publication d’atlas de diagrammes en unités normalisées S.I.D’autres encore se rapportent au domaine des moteurs à combustion interne pour l’interprétation des processus de combustion et de leur rendement, notamment pour le pseudocycle Beau de Rochas du moteur à essence et le pseudocycle Diesel. Sous ce rapport, la coutume d’utiliser le terme de cycle pour de tels processus est en contradiction avec sa définition thermodynamique puisque l’état initial du combustible est manifestement différent de son état final (gaz brûlés). Inversement, la dénomination de pseudocycle peut convenir pour les machines à pistons en raison du caractère périodique de leur mouvement.
Dans ce dernier cas, et contrairement au précédent, la solution est liée à la durée du processus ce qui implique fatalement l’intervention des lois cinétiques de transport (conduction, convection, rayonnement) étrangères à la thermodynamique et souvent même partiellement empiriques. On ne peut traiter que des cas particuliers et sous ce rapport, la dénomination de Thermodynamique à temps fini parfois utilisée pour ce genre de problème est pour le moins inappropriée, sinon redondante.3. Diagrammes d’état. Cycles et pseudocycles usuelsLe diagramme thermodynamique pression-volume, dénommé diagramme de Clapeyron, ou en bref diagramme (p , V), est manifestement le plus simple à interpréter à partir de connaissances élémentaires. De plus, son analogie avec les relevés de l’indicateur de Watt ont répandu son emploi depuis le début de l’ère des machines à pistons. Néanmoins il est loin d’être le plus commode et le plus instructif pour qui est quelque peu familiarisé avec la seconde loi de la thermodynamique. Cette réflexion, déjà inspirée à J. W. Gibbs semble bien avoir été le stimulant initial en faveur de l’élaboration de son important mémoire consacré aux diagrammes et aux surfaces thermodynamiques. Les constructions géométriques qu’il a fait connaître ont largement contribué à répandre l’usage des méthodes graphiques dans cette discipline.Sous ce rapport, le diagramme température-entropie, appelé aussi diagramme entropique ou diagramme (T, S), mérite quelques commentaires. Ainsi que le montre la figure 1, le cycle réversible de Carnot qui assure le rendement optimum d’une machine fonctionnant entre deux températures données 1 et 2, y est représenté par un simple rectangle. En outre, l’aire de ce rectangle mesure le travail accompli au cours du cycle, alors que l’aire 1-2-5-6, étendue jusqu’au zéro absolu, mesure la chaleur fournie par la source chaude 2. Il en résulte enfin que le rendement moteur s’interprète graphiquement par le rapport du segment 1-4 au segment 1-6. Cette propriété est générale car indépendante de la nature du milieu en évolution. Elle s’applique en outre à tous les cycles réversibles, comme on peut l’observer sur la figure 2. Le travail y est encore mesuré par l’aire de la boucle et la chaleur fournie par l’aire 6-1-2-3-5, tandis que la représentation du rendement correspond ici au rapport de ces deux aires.D’autre part, l’application du diagramme entropique au domaine des gaz parfaits, où il porte le nom de diagramme de Stodola conduit directement à la construction graphique exposée à l’article ENTROPIE. La famille des isobares (pression constante) ainsi que celle des isomètres (ou isochores, volume constant), obtenues à partir de l’une d’entre elles par simple déplacement parallèle à l’axe des abscisses, forment un réseau d’exponentielles ayant respectivement pour sous-tangente les capacités calorifiques Cp et Cv supposées constantes dans la région envisagée. C’est ainsi notamment que le cycle de Joule défini au moyen de deux isobares et de deux adiabatiques réversibles (S = C te ) s’y représente sans difficulté. Il a connu un regain d’intérêt par suite de l’important développement de l’industrie des turbines à gaz.Dans le domaine des vapeurs condensables, ce même type de cycle porte le nom de Rankine ou de Rankine-Hirn, selon que la vaporisation est arrêtée à la sortie de la chaudière (cf. fig. 3, point 4 de saturation sèche; cas de la machine à pistons), ou qu’elle est prolongée par une surchauffe supplémentaire (point 5, cas de la turbine). La position de ce dernier point doit permettre d’accomplir la détente adiabatique ultérieure 5-6, à l’abri de toute manifestation de condensation. En effet, la vitesse généralement considérable atteinte par la vapeur au cours de sa détente provoquerait fatalement une dangereuse abrasion du métal des parois par suite de la projection violente des gouttelettes engendrées.Dans le cas fréquent où le volume spécifique du liquide est négligeable devant celui de la vapeur en équilibre, le travail utile de compression (Vliq p ) par unité de masse, consommé par la pompe d’alimentation de la chaudière, l’est également. Dès lors, les points 1 et 2 de la figure 3 sont régulièrement confondus dans les diagrammes usuels (superposition du réseau des isobares de l’état liquide à la courbe limite de la zone d’équilibre x = 0).Les conséquences du premier principe présentées soit sous la forme (23), ci-dessus, soit sous la forme (3) de l’article B (Lois fondamentales), confèrent aux accroissements d’enthalpie, des propriétés énergétiques essentielles, telles que la mesure de la chaleur échangée avec le milieu extérieur le long d’un arc d’isobare, la mesure du travail utile ou celle d’un accroissement d’énergie cinétique, le long d’un tronçon d’adiabatique. Ces diverses propriétés ont largement contribué à mettre en valeur l’intérêt du diagramme enthalpie – entropie H, S, de Mollier, où ces accroissements sont directement mesurés par de simples différences d’ordonnées. Il possède de surcroît l’avantage de permettre la représentation graphique des propriétés des mélanges. En effet, tout diagramme reposant sur le choix de coordonnées homogènes et linéaires par rapport aux masses autorise l’application graphique de la règle des mélanges, soit, en d’autres termes, la détermination classique d’un centre de masse. C’est ainsi que le diagramme (V, S) de Gibbs permet de remplacer par un triangle l’état triple réduit à un point dans le diagramme température-pression (T, p ).La possibilité d’une représentation simultanée de la règle des mélanges et des lois d’équilibre devait permettre ultérieurement à l’école hollandaise de Van der Waals, Kamerlingh-Onnes, Keesom, de Haas et quelques autres d’utiliser le diagramme (H, S, titre), pour leurs études graphiques de séparation, rectification, et distillation des mélanges binaires, consécutifs à la liquéfaction des gaz aux basses températures. Il faut citer aussi parallèlement les importantes contributions théoriques de Duhem en France sur les propriétés des nappes d’ébullition et de condensation, à partir des mêmes méthodes.À présent, l’usage des diagrammes et surfaces thermodynamiques s’est répandu dans les domaines les plus variés de la discipline. Les uns concernent la climatisation et le conditionnement de l’air (diagrammes psychrométriques), les autres, l’industrie frigorifique, où la multiplication du nombre des agents appropriés aux différentes régions de températures, tantôt basses, tantôt relativement élevées pour les pompes à chaleur, a entraîné la publication d’atlas de diagrammes en unités normalisées S.I.D’autres encore se rapportent au domaine des moteurs à combustion interne pour l’interprétation des processus de combustion et de leur rendement, notamment pour le pseudocycle Beau de Rochas du moteur à essence et le pseudocycle Diesel. Sous ce rapport, la coutume d’utiliser le terme de cycle pour de tels processus est en contradiction avec sa définition thermodynamique puisque l’état initial du combustible est manifestement différent de son état final (gaz brûlés). Inversement, la dénomination de pseudocycle peut convenir pour les machines à pistons en raison du caractère périodique de leur mouvement.
Encyclopédie Universelle. 2012.
